富山大学 研究者インタビュー#40
2025年9月29日

迫野 昌文 先生
富山大学 工学系 准教授
迫野先生は、タンパク質工学を基盤に、細胞内で起こるタンパク質の変性やDNAの微細な変異を、
分子レベルで正確に識別・修復する技術の開発に取り組んでいます。
私たちの体や細胞を構成するタンパク質は、多いものでは数千個のアミノ酸が結合した複雑なものですが、その配列に1箇所でも変異が起こると構造も壊れはじめます。この状態では、正しい機能が発揮できないばかりではなく、壊れたもの同士が凝集して疾患の原因にもなります。このような凝集物はアミロイドと呼ばれ、特にアルツハイマー病の原因であるアミロイドβはよく知られています。
一方、農業などで品種改良のために用いられるゲノム編集技術においては、その目的を達成し、安全性も担保するために、長いDNAの中で編集すべき特定の箇所を正確に検出する技術が必要とされています。
このような複雑な生体分子に関わる課題に、タンパク質を巧みに操ることで解決しようと取り組んでいるのが、工学部応用化学コースの迫野先生です。
迫野先生は、高校生の時に書籍『精神と物質』で利根川進先生の考えに触れたことをきっかけに、『化学』が全ての科学分野の基盤となると考え、大学進学時には応用化学の道に進みます。その後、所属した研究室では『ミセル』や『逆ミセル』と呼ばれる分子集合体を使って物質を抽出する研究を行っていましたが、当時留学から戻ってきた助教が、医療に役立つタンパク質やDNA研究の可能性を示されたことで、研究は新たな方向へと進むことになります。
「逆ミセルは中に水や親水性の分子を閉じ込めることのできる構造を持ちますが、うまく設計すれば内側にちょうどタンパク質1個分のスペースを作ることができます。僕たちは、『逆ミセルで壊れたタンパク質を捕まえ、その中で修復する』というチャレンジングなテーマ(図1)に一から取り組むことになったのです。」
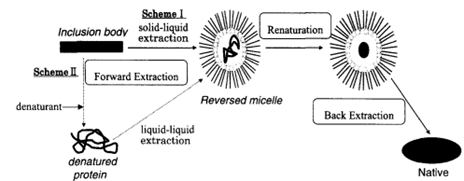
図1 変性タンパク質を逆ミセルで包み込み、その内部で修復を行う実験スキーム(出典:https://doi.org/10.1016/S1389-1723(00)89096-9)
生物学を独学で勉強しながら研究を進める中で、先生はある体内の仕組みに注目しました。私たちの細胞の中はタンパク質が非常に多く、凝集しやすい環境ですが、通常はそうならずにバランスが保たれています。それは、『分子シャペロン』と呼ばれるタンパク質が、壊れかけたタンパク質の形を元に戻すように補助しているためです。
「僕たちが逆ミセルでやろうとしていたのは、この分子シャペロンを模しているんだ」
と考えた先生は、分子シャペロンの仕組みそのものを研究したいという思いを持つようになりました。そして博士課程を終えた後、理化学研究所でタンパク質の合成やゲノム編集の技術を習得し、現在の研究の土台となる知識を得たのです。
アルツハイマー病やプリオン病など、タンパク質が壊れて凝集してしまったアミロイドが原因となる疾患は数多く存在します。迫野先生は、これらタンパク質変性病をターゲットにした分子シャペロンに関する研究を始めることにしました。このテーマに関しては、現在に至るまで画期的な研究成果をコンスタントに発表しています。
「例えば、あるアミロイドと、あるシャペロンはすごくよく相互作用して、変性(壊れ)を抑制してくれるという研究成果は、自分たちのものを含めいくつも報告されています。しかし、これがなぜ起きているのか理解するのはとても難しいです。僕たちの研究室では、分子シャペロンがどのようにしてタンパク質の変性を抑制しているのか、具体的には変性の原因となる細胞毒性や細胞へのストレスへの緩和に寄与しているかという点に結びつけて、分子レベルでメカニズム解明を行っています。」
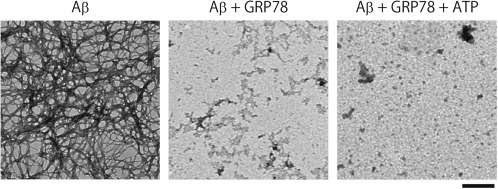
図2 アミロイドβ(Aβ)が分子シャペロンGRP78の存在下で凝集が抑制されることを観察した電子顕微鏡写真。GRP78は、エネルギー源であるATPがなくてもAβの凝集を抑制することから、細胞ストレス環境下でも同様の働きが期待できる。
(出典:https://doi.org/10.1016/j.bbrc.2017.08.162)
迫野先生はこれまで培ってきたタンパク質工学の知見を活かして、遺伝データであるDNAの変異点や特定の箇所を1分子レベルで検出する方法も研究しています。
「ゲノム編集という技術では、長いゲノムの中で編集すべき特定の部分を正確に狙う必要があります。また、僕たちの体ではDNAのたった1塩基(A・T・G・C)違うだけで病気になってしまいます。この違いを正確に見つけられるものができれば、将来的には正常な細胞には全くダメージを与えずに、異常な時だけそばにいって補修することができる、安全性の高い編集技術になると期待しています。」
この研究で注目されているのが、DNA配列を認識できるTALE(転写活性化様エフェクター / Transcription Activator-Like Effector)というタンパク質です。迫野先生は、このTALEをベースに、ミスマッチ法という独自の技術で設計を行い、DNAの1塩基の違いを高精度に識別することに成功しました。ミスマッチ法は、TALEにターゲット配列とのミスマッチ(ズレ)を敢えて作成し、ターゲット配列との結合性を高めるという斬新なものです。さらに、目的に応じて複数のTALEをデザインし、それらを組み合わせることで、狙った塩基や配列を正確にとらえることが可能となり、ゲノム編集の精度と安全性を大幅に向上させる、非常に有望な技術と言えます。
タンパク質を中心に研究に取り組まれている迫野先生ですが、同じく研究者である配偶者の迫野奈緒美先生(富山高専)とはナノ粒子触媒の研究に共同で取り組まれています。こちらの研究も世界的に権威ある化学系学術誌『ACS Applied Nano Materials』に掲載、さらにFront Coverに採択されるなど、注目を集めています。『化学』という基盤を通じて、医療・農業・環境など社会の幅広い課題に科学の力で立ち向かう迫野先生の探究心と挑戦は、これからも進化を続けていきます。
共同研究等のご相談はOneStop窓口からお願いします。
(文責:学術研究・産学連携本部 コーディネーター 浮田)
富山大学工学部応用化学コース生体物質化学研究室
http://www3.u-toyama.ac.jp/biochem/
http://enghp.eng.u-toyama.ac.jp/labs/ac05/
富山大学研究者プロファイルpure https://u-toyama.elsevierpure.com/ja/persons/masafumi-sakono/
Researchmap https://researchmap.jp/read0138828